预约39元在线试听课 满意后报名

报名课程 专属福利随意领
*2470人已预约,首课体验不满意,可全额退费。
— — 报名课程可获得 — —
海量资料包
干货公开课
标准化串讲
综合能力训练
| 官网福利丨点击免费领取>> 小初高学习礼包! |
强、弱电解质的判断方法
1.电离方面:不能全部电离,存在电离平衡,如
(1)0.1 mol·L-1CH3COOH溶液pH约为3;
(2)0.1 mol CH3COOH溶液的导电能力比相同条件下盐酸的弱;
(3)相同条件下,把锌粒投入等浓度的盐酸和醋酸中,前者反应速率比后者快;
(4)醋酸溶液中滴入石蕊试液变红,再加CH3COONH4,颜色变浅;
(5)pH=1的CH3COOH与pH=13的NaOH等体积混合溶液呈酸性等。
2.水解方面
根据电解质越弱,对应离子水解能力越强
(1)CH3COONa水溶液的pH>7;
(2)0.1 mol·L-1 CH3COONa溶液pH比0.1 mol·L-1 NaCl溶液大。
3.稀释方面
如图:a、b分别为pH相等的NaOH溶液和氨水稀释曲线。c、d分别为pH相等的盐酸和醋酸稀释曲线。
请体会图中的两层含义:
(1)加水稀释相同倍数后的pH大小:氨水>NaOH溶液,盐酸>醋酸。若稀释10n倍,盐酸、NaOH溶液pH变化n个单位,而氨水与醋酸溶液pH变化不到,n个单位。
(2)稀释后的pH仍然相等,则加水量的大小:氨水NaOH溶液,醋酸>盐酸。
4.利用较强酸(碱)制备较弱酸(碱)判断电解质强弱。如将醋酸加入碳酸钠溶液中,有气泡产生。说明酸性:CH3COOH>H2CO3。
5.利用元素周期律进行判断,如非金属性Cl>S>P>Si,则酸性HClO4>H2SO4>H3PO4>H2SiO3(较高价氧化物对应水化物);金属性:Na>Mg>Al,则碱性:NaOH>Mg(OH)2>Al(OH)3。
特别提醒
证明某电解质是弱电解质时,只要说明该物质是不完全电离的,即存在电离平衡,既有离子,又有分子,就可说明为弱电解质。
方法点拨
判断弱电解质的三个思维角度:
角度一:弱电解质的定义,即弱电解质不能完全电离,如测0.1 mol·L-1的CH3COOH溶液的pH>1。
角度二:弱电解质溶液中存在电离平衡,条件改变,平衡移动,如pH=1的CH3COOH加水稀释10倍后,1<pH<2。
角度三:弱电解质形成的盐类能水解,如判断CH3COOH为弱酸可用下面两个现象:
(1)配制某浓度的醋酸钠溶液,向其中加入几滴酚酞溶液。现象:溶液变为浅红色。
(2)用玻璃棒蘸取一定浓度的醋酸钠溶液滴在pH试纸上,测其pH。现象:pH>7。
 保存 |
保存 |
 打印 |
打印 |
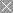 关闭
关闭
